Sifat Sifat Keperiodikan Unsur beserta Penjelasannya
Salam sejahtera bagi kita semua, kali ini kami akan memberikan informasi tentang Sifat Keperiodikan Unsur lengkap dengan penjelasannya. Semoga dapat dimengerti dan mudah dipahami, Oke langsung saja kita mulai pembahasannya.
Sifat Keperiodikan Unsur
Sifat keperiodikan unsur adalah sifat-sifat yang berubah secara beraturan sesuai dengan kenaikan nomor atom unsur.
Berikut Sifat Keperiodikan Unsur dalam Sistem Periodik
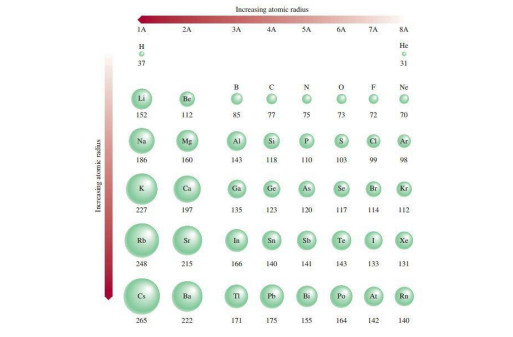
Jari-Jari Atom
Jari-jari atom adalah jarak dari inti atom ke kulit elektron terluar. Jari-jari atom diartikan sebagai jarak elektron terluar dari inti atom dan menunjukkan ukuran atom. Jari-jari atom sulit diukur, sehingga pengukuran jari-jari atom dilakukan dengan mengukur jarak antar inti antara dua atom yang saling mengikat.
- Dalam satu golongan dari atas ke bawah jari-jari atom semakin besar.
- Dalam satu periode dari kiri ke kanan, jari-jari atom semakin kecil.
Pada gambar di atas terlihat bahwa dalam satu golongan, jari-jari atom semakin ke atas cenderung semakin kecil. Hal ini terjadi karena semakin ke atas,kulit elektron semakin kecil. Dalam satu periode, semakin ke kanan jari-jari atom cenderung semakin kecil.
Hal ini terjadi karena semakin ke kanan jumlah proton dan jumlah elektron semakin bertambah sedangkan jumlah kulit terluar yang terisi elektron tetap sama sehingga tarikan inti terhadap elektron semakin kuat.
Gambar di atas menunjukan keteraturan perubahan jari-jari atom yang merupakan sifat periodik unsur.
Penjelasan:
1) Dalam satu golongan dari atas ke bawah, kulit atom bertambah (ingat jumlah kulit=nomor periode)
sehingga jari-jari atom juga bertambah besar.
2) Dari kiri ke kanan, jumlah kulit tetap tetapi muatan inti (nomor atom) dan jumlah elektron pada kulit bertambah. Hal tersebut mengakibatkan gaya tarik-menarik antara inti dengan kulit elektron semakin besar sehingga jarijari atom makin kecil.
Energi Ionisasi
Energi ionisasi adalah energi minimum yang dibutuhkan untuk melepaskan elektron dari atom netral dalam keadaan gas. Energi yang dibutuhkan untuk melepaskan elektron kedua disebut energi ionisasi kedua, dan seterusnya.
Energi ionisasi adalah energi ionisasi pertama, kecuali jika ada penjelasan khusus.
Bila tidak ada keterangan khusus maka yang disebut energi ionisasi adalah energi ionisasi pertama.
Tahapan pelepasan elektron tersebut dapat digambarkan sebagai berikut :
M(g) → M+
(g) + e– Ei-1
M+
(g) → M2+(g) + e– Ei-2
Maka dapat ditulis Na → Na+ + e–
Atom Na akan kehilangan elektron dan kelebihan satu muatan positif, atau
dengan kata lain atom Na berubah menjadi ion Na+. Peristiwa yang terjadi pada
atom ini diperlukan energi, karena terjadinya perubahan kedudukan elektron.
Karena semua atom kecuali hidrogen mempunyai lebih dari satu elektron, maka
atom-atom ini juga mempunyai lebih dari satu energi ionisasi. Bila pelepasan
melibatkan elektron pertama, disebut EI pertama, dan jika elektron kedua yang
terlibat disebut EI kedua, dan seterusnya.
E. ionisasi 1 : Na (g) + E1 → Na+
(g) + e–
E. ionisasi 2 : Na+
(g) + E2 → Na2+ (g) + e–
Harga energi ionisasi dipengaruhi oleh jari-jari atom dan jumlah elektron valensi
atau muatan inti.
Semakin kecil jari-jari atom, harga energi ionisasi akan
semakin besar. Semakin besar muatan inti, energi ionsasi cenderung akan
semakin besar.
Dapat disimpulkan keperiodikan energi ionisasi sebagai berikut.
- Dalam satu golongan dari atas ke bawah energi ionisasi semakin berkurang.
- Dalam satu periode dari kiri ke kanan energi ionisasi cenderung bertambah.
1. Energi ionisasi (EI) pertama selalu lebih rendah dari EI kedua. Hal tersebut
menunjukkan bahwa semakin sulit melepaskan elektron berikutnya.
Keadaan ini dikarenakan semakin dekatnya elektron dengan inti atom
sehingga semakin kuatnya gaya tarik-menarik inti terhadap elektron.
2. Dalam satu perioda, umumnya energi ionisasi (EI) meningkat dari kiri ke
kanan, searah dengan meningkatnya nomor atom. Hal ini dikarenakan kulit
valensinya tetap sementara muatan inti bertambah positif sehingga volume
inti atom meningkat dan nilai jari-jari atom berkurang.
3. Dalam satu golongan, energi ionisasi (EI) menurun dari atas ke bawah
searah meningkatnya nomor atom. Hal ini dikarenakan muatan inti
bertambah positif sehingga kulit atom bertambah (volume bertambah) dan
nilai jari-jari atom meningkat. Keadaan ini menyebabkan gaya tarik-menarik
inti terhadap elektron terluar semakin lemah. Akibatnya, EI semakin
berkurang.
4. Energi ionisasi (EI) pertama unsur golongan VIIIA paling tinggi di antara
golongan unsur yang lain. Hal itu terjadi karena konfigurasinya yang penuh
pada kulit terluar yang membuatnya stabil. Kestabilan ini disebabkan atomatom gas mulia memiliki elektron valensi paling banyak (8 elektron). Oleh
karena itu, untuk mengeluarkan elektron valensi dari atom gas mulia
memerlukan EI yang sangat besar.
Afinitas Elektron
Afinitas elektron adalah besarnya energi yang dibebaskan satu atom netral
dalam wujud gas pada waktu menerima satu elektron sehingga terbentuk ion
negatif.
- Dalam satu golongan dari atas ke bawah afinitas elektron semakin kecil.
- Dalam satu periode dari kiri ke kanan afinitas elektron semakin besar.
Keelektronegatifan
Keelektronegatifan Adalah suatu bilangan yang menyatakan kecenderungan suatu unsur menarik
elektron dalam suatu molekul senyawa. Keelektronegatifan adalah besaraan
tendensi (kecenderungan) suatu atom untuk menarik elektron.
Harga
keelektrogenatifan bersifat relatif (berupa harga perbandingan suatu atom
terhadap atom yang lain). Salah satu definisi kelektronegatifan adalah definisi
Pauling yang menghasilkan data skala kuantitatif.
- Dalam satu golongan dari atas ke bawah keelektronegatifan semakin berkurang
- Dalam satu periode dari kiri ke kanan keelektronegatifan semakin bertambah.
Sifat Logam Dan Nonlogam
Secara kimiawi sifat logam berkaitan dengan elektropositif, yaitu kecenderungan atom melepaskan elektron membentuk ion positif. Karenanya, sifat-sifat logam akan bergantung pada energi ionisasi. Semakin besar energi ionisasi untuk melepaskan elektron, semakin sedikit logamnya. Di sisi lain, sifat non-logam berkaitan dengan elektronegativitas, yang merupakan kecenderungan atom untuk menarik elektron.
Sifat
logam dan nonlogam dalam sistem periodik unsur adalah sebagai berikut :
- Dari kiri ke kanan dalam satu periode,sifat logam berkurang, sedangkan sifat nonlogamnya bertambah
- Dari atas ke bawah dalam satu golongan, sifat logam bertambah, sedangkan sifat nonlogam berkurang.
Kereaktifan (Kemudahan Berekasi)
Kereaktifan suatu unsur bergantung pada kecenderungannya melepas atau
menarik elektron. Jadi, unsur logam yang paling reaktif adalah golongan IA
(logam alkali), sedangkan nonlogam yang paling reaktif adalah golongan
VIIA (halogen). Dari kiri ke kanan dalam satu periode,mula-mula kerekatifan
menurun kemudian bertambah hingga ke golongan VIIA. Golongan VIIIA
tidak reaktif